2025年1月,题目为“Enhancing hydrogen storage performance of magnesium-based materials: A review on nanostructuring and catalytic modification”论文在线发表于Journal of Magnesium and Alloys。该研究由中山大学完成,通讯作者为姚向东教授。
创新点
这篇综述全面详述了纳米结构技术的最新进展,阐明了这些方法如何通过改善氢气的吸收和脱附动力学,显著提高镁基材料的储氢性能。
该综述探讨了各种催化剂(包括碳基材料、过渡金属及其合金以及它们的复合材料)在降低氢气吸收和释放温度方面的作用,从而提高镁基储氢材料的整体效率。
该综述指出了当前面临的挑战,并提出了未来的研究方向,强调了理论建模的重要性以及为解决诸如热导率、缩放和与燃料电池的实际应用等问题而寻求创新解决方案的必要性。
研究背景
本文聚焦于镁基储氢材料的研究进展。鉴于化石能源消耗与环境污染问题,氢能因高能量密度和环保特性成为理想替代能源,而固态储氢尤其是镁基材料因储量丰富、成本低、储氢容量高(7.6 wt%)等优势备受关注。然而,镁基材料存在操作温度高、吸放氢速率慢的瓶颈,为此研究人员通过纳米结构化、催化剂添加及合金化等手段优化其性能,其中纳米结构化与催化技术在不降低储氢容量的前提下,有效改善了反应动力学。本综述系统梳理了上述改进策略,剖析当前技术局限,并展望未来跨学科协作与创新方法在镁基储氢材料实用化中的发展方向。
结果讨论
2. 镁/氢化镁体系基础
2.1.热力学障碍
为提升镁基储氢体系的设计以改善储氢性能,深入理解MgH₂高工作温度相关的能量势垒至关重要。其中关键障碍是MgH₂的形成焓,其决定了Mg-H键的强度。理论计算表明,MgH₂的键合性质为离子键与共价键的混合,以离子相互作用为主(图1a),其态密度(DOS)显示导带主要受Mg(3s)和Mg(2p)轨道影响,而价带中Mg(3s/2p)与H(1s)轨道杂化形成部分共价作用,这种键合特性赋予MgH₂高热力学稳定性,导致其脱氢焓高且室温下平台压力极低。Mg的氢化过程通常包括含氢固溶体(α相)形成、MgH₂(β相)的成核生长,脱氢过程则与之相反。通过测量不同温度下的压力-组成等温(PCI)曲线(图1b),利用van’t Hoff方程可求得形成焓和熵,MgH₂的吸/脱氢反应焓通常为76 kJ/mol H₂。图1c显示氢化镁的平台压力随温度变化,表明在1 bar压力下需高于550 K才能实现MgH₂解吸,而常规动力学真空条件虽能促进脱氢,却会降低材料应用的可行性和成本效益。目前,纳米化与合金化已被证实是改善其热力学性能的有效手段。
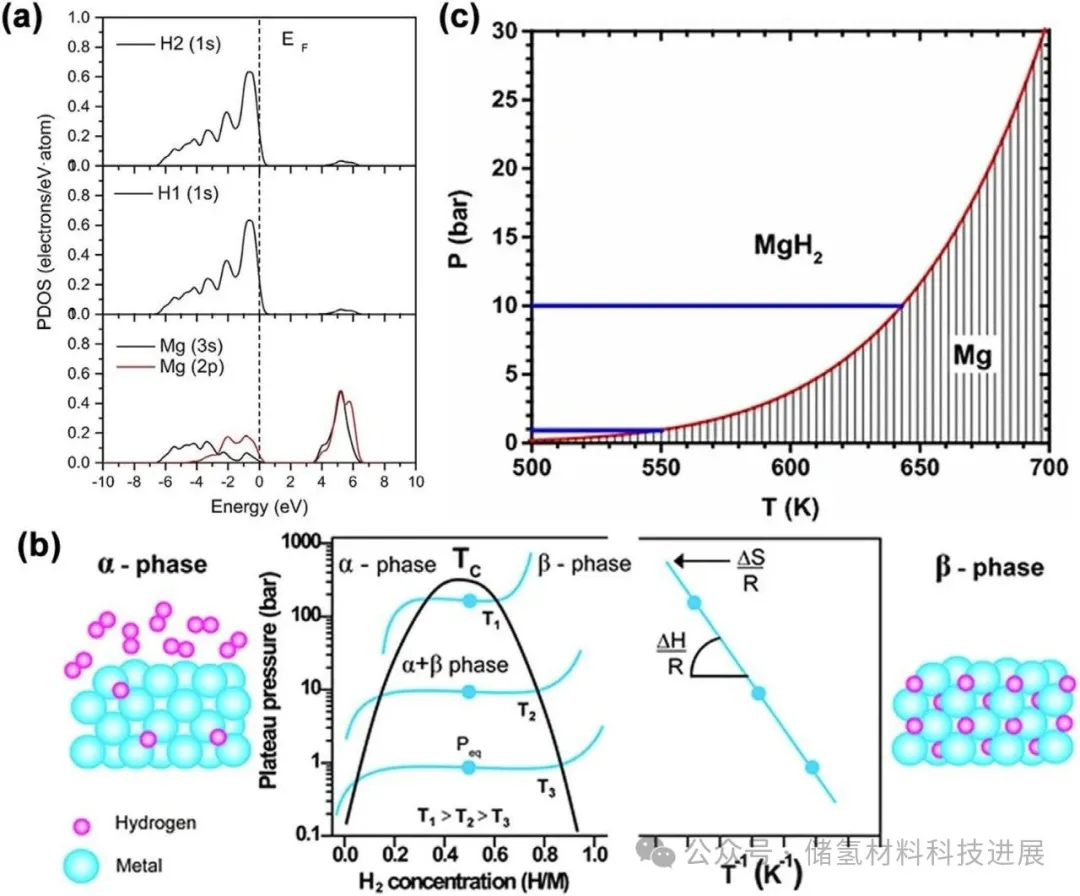
图1:(a) MgH₂中H1、H2和Mg原子的投影态密度(PDOS)。(b) 金属向金属氢化物转变过程中压力与组成的变化曲线及相关的van’t Hoff图,图中斜率和截距分别对应氢化物形成与分解的焓和熵。(c) 氢化镁平台压力随温度的变化
2.2.动力学障碍
MgH₂动力学迟缓导致工作温度高,这是另一重大挑战。作为典型气固反应,Mg氢化过程包含吸附、解离、扩散及成核生长四个关键阶段(图2),每个阶段均需跨越能垒(反应活化能),其中氢解离活化能高达1.4 eV,成为吸氢初始阶段的速率控制步骤,而氢在Mg中扩散速率低(493–473 K时为4×10⁻¹³ m²/s),且Mg颗粒表面初始形成的MgH₂因扩散速率更低(300–600 K时为1.5×10⁻¹⁶ m²/s)会抑制扩散,加之Mg表面形成的氧化/氢氧化物钝化层进一步阻碍氢解离与扩散。脱氢时,脱附速率主要受Mg-H键断裂、氢原子从MgH₂内部向表面扩散及氢原子重组的影响,而MgH₂低热导率(0.4 W/m·K)也对传热构成挑战。评估MgH₂吸脱氢动力学性能常用基于成核生长理论的JMAK模型,反应活化能(Ea)可通过Arrhenius方程确定。
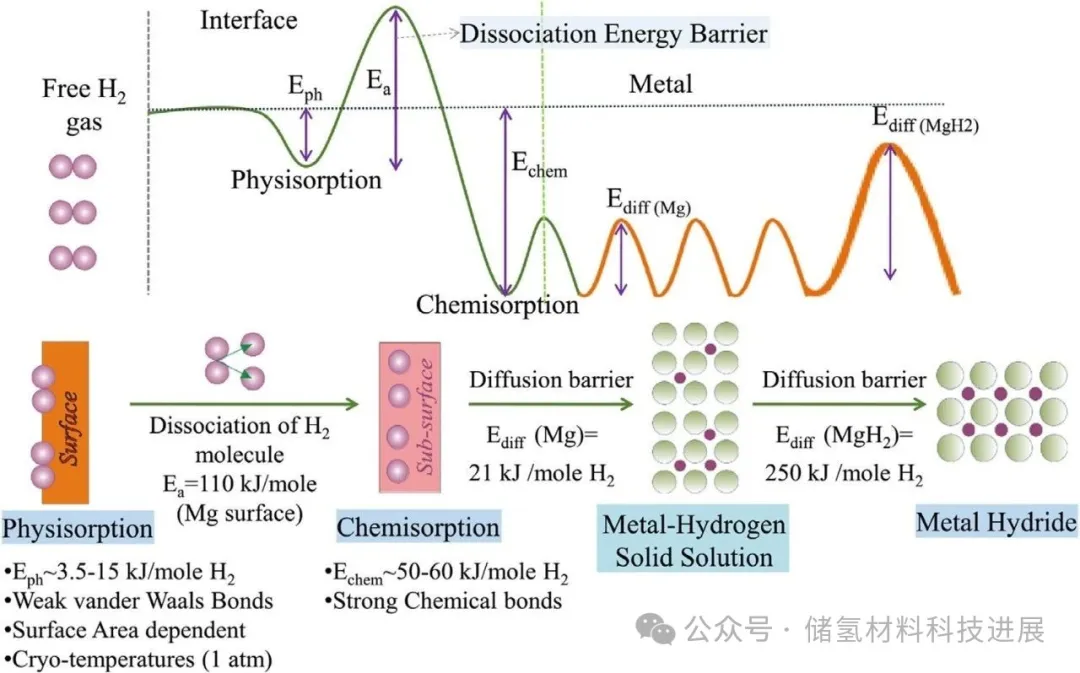
2.3.尺寸效应与催化作用
当前研究致力于降低MgH₂的热力学稳定性并改善其吸脱氢动力学,采用的方法包括合金化、催化剂添加、纳米结构化及与硼氢化物等氢化物形成纳米复合材料。其中,纳米结构化因能在不损害储氢容量的前提下同时改善Mg的热力学与动力学性能而备受关注,纳米级Mg/MgH₂因表面积与量子尺寸效应展现出独特性质,研究表明其粒径减小会导致生成热增加、解吸温度降低,50 nm以下的纳米颗粒更易实现动力学增强。催化剂则通过“氢泵效应”、“溢出效应”、“通道效应”、“电子转移效应”等机制降低反应活化能,加速吸脱氢过程,同时可能产生尺寸效应与纳米限域效应,但催化界面与机制仍需深入研究。此外,纳米结构化主要通过增加表面积与活性位点优化储氢性能,而催化剂在氢分子解离/重组及氢原子扩散中起关键作用,二者在吸脱氢反应中的作用机制存在不对称性。
3. 纳米结构化
综上所述,镁基储氢材料因其高储氢容量、安全性和丰富的可获得性,在可持续能源应用中展现出巨大潜力。然而,动力学缓慢和操作温度高等挑战阻碍了其实际应用。本综述重点介绍了两种主要改性策略的进展:纳米结构化和催化。
图5展示了球磨条件下粉末的变形行为及等离子体辅助球磨技术。机械球磨过程中,磨球的撞击使Mg/MgH₂颗粒经历压缩、弹性与塑性变形,导致粒径减小、表面面积增加及晶格缺陷引入,从而改善储氢性能。而介质阻挡放电等离子体辅助球磨(P-milling)设备通过等离子体粒子与金属粉末的高能碰撞,使粉末熔融、蒸发并释放热应力,结合磨球的机械力,显著提升合金化与细化效率。例如,P-milling合成的Mg(In)-MgF₂复合材料脱氢活化能降至127.7 kJ/mol,623 K下15分钟内释氢4.0 wt%,优于纯MgH₂。
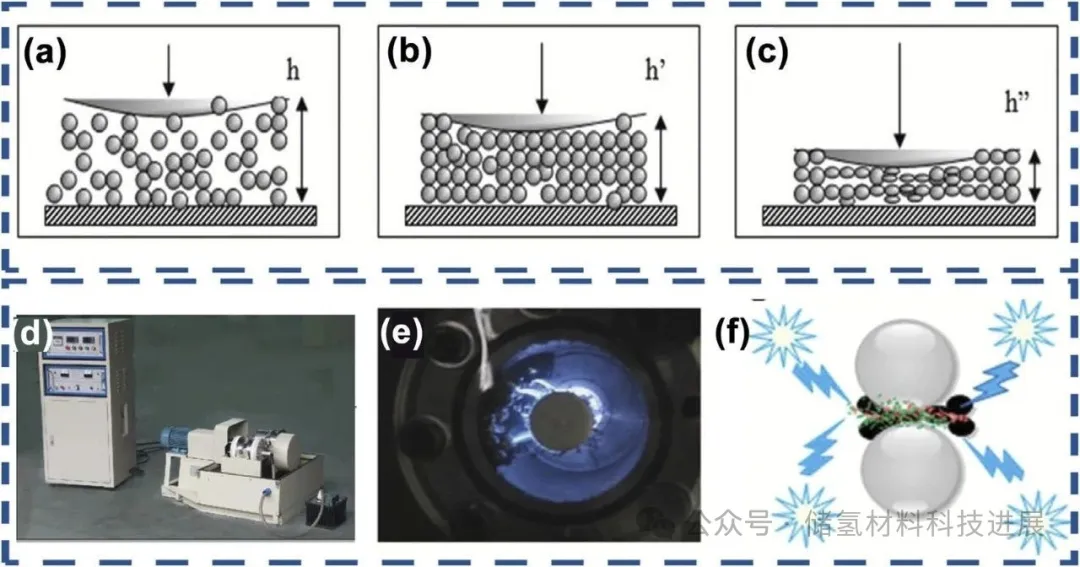
图5:球磨条件下粉末团聚体的变形行为示意图:(a) 磨球撞击前的粉末颗粒;(b) 被磨球压缩的粉末颗粒;(c) 弹性与塑性变形的发生;(d) 介质阻挡放电等离子体辅助球磨设备;(e) 0.1 MPa氩气中介质阻挡放电等离子体辐射的图片;(f) 放电等离子体球磨技术的影响图解
图6展示了氢等离子体-金属反应法(HPMR)的装置与产物表征。该方法将镁块置于1 bar的70% Ar/30% H₂混合气体中电弧熔融,通过100 L/min的循环气流收集到平均粒径300 nm的Mg超细颗粒。此外,化学还原法合成的25 nm Mg纳米晶在300 °C下的吸氢速率比38 nm颗粒快7倍以上,归因于更小粒径带来的缺陷密度增加与扩散路径缩短,证实纳米尺寸对动力学的显著提升。
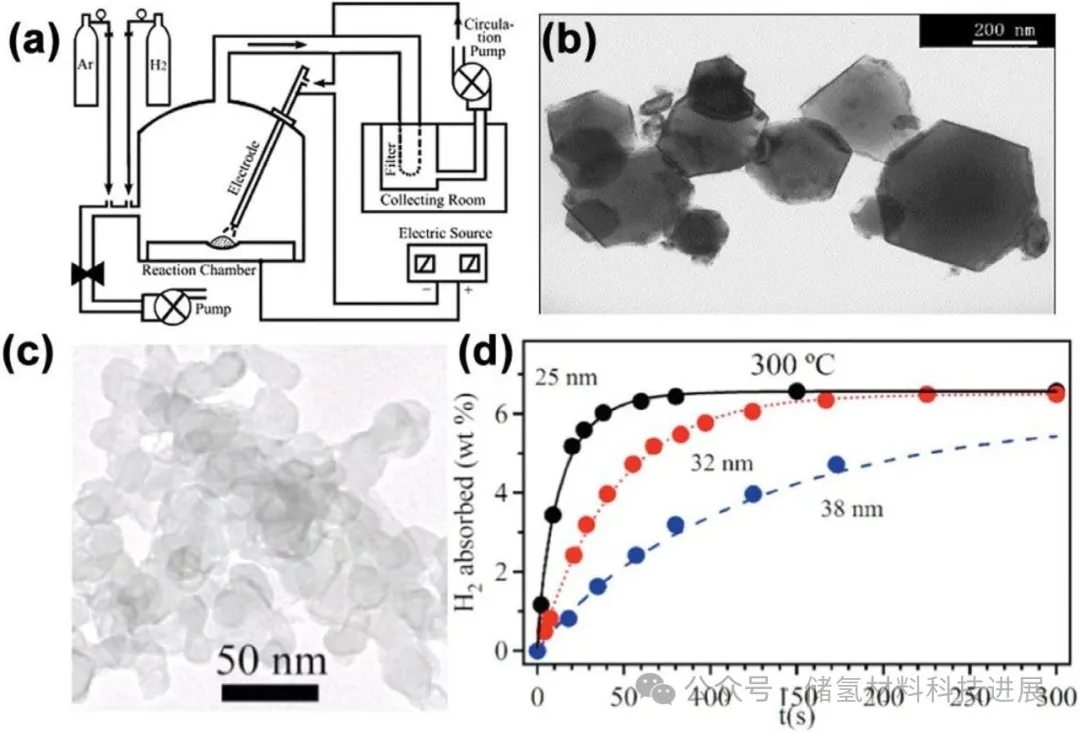
图6:(a) 氢等离子体-金属反应法装置示意图;(b) 镁超细颗粒的明场电子显微图;(c) 25 nm Mg纳米晶样品的TEM图;(d) 300 °C下Mg纳米晶样品的吸氢曲线
图7的示意图通过调控氢化温度与压力细化MgH₂晶粒的机制。根据成核生长理论,降低氢化温度可提高成核速率,形成更细小的MgH₂晶粒;增加H₂压力则加速氢分子解离与扩散,同时促进成核与晶体生长。在室温1 bar条件下,该方法可制备平均尺寸5.2 nm的MgH₂纳米晶,但循环过程中纳米晶稳定性较差,易在吸脱氢循环中团聚长大,限制了实际应用。
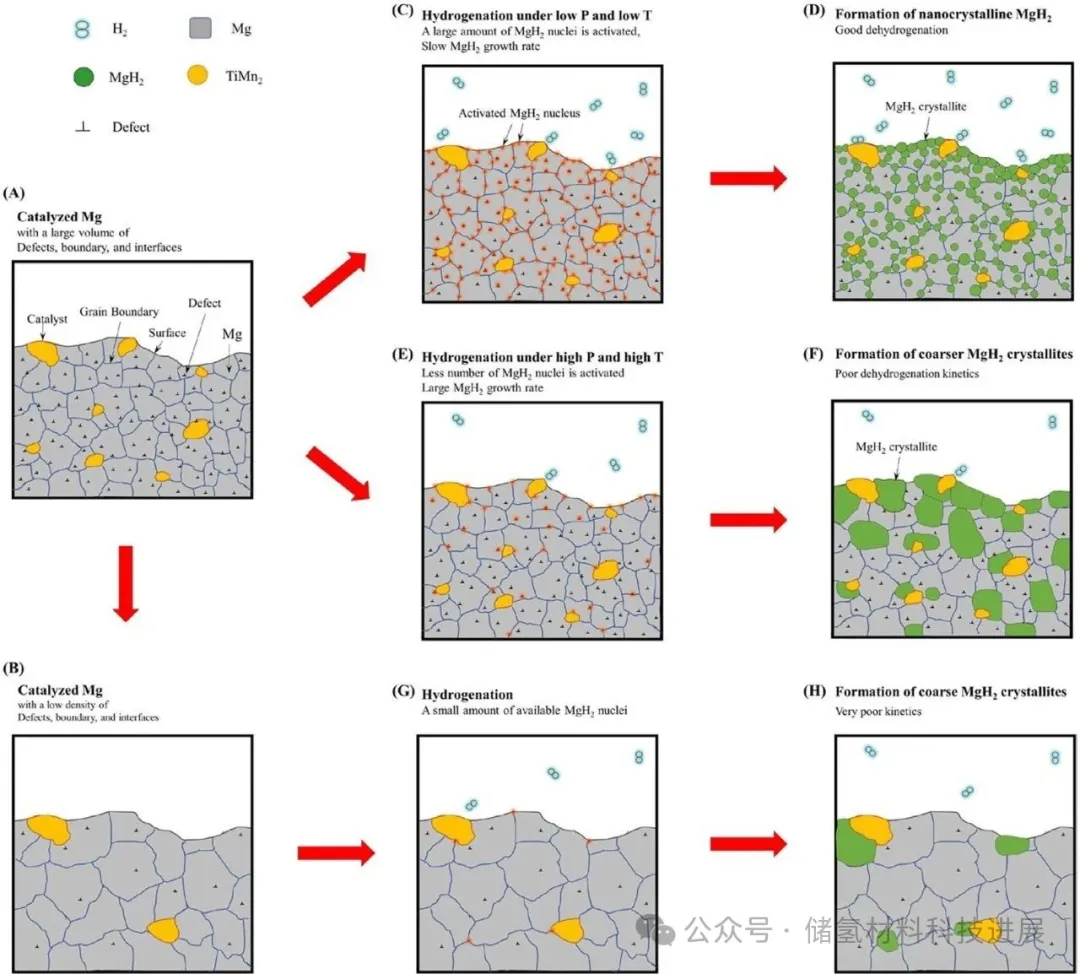
图7:调控氢化过程制备Mg纳米晶的形成机理示意图
图8展示了气相传输法制备的直径可控Mg纳米线(30-50 nm),其动力学与热力学性能显著优于块体Mg。373-573 K下,纳米线的吸脱氢活化能分别为33.5 kJ/mol和38.8 kJ/mol,脱氢焓降至65.3 kJ/mol,且30-50 nm直径的纳米线性能最优。此外,电化学法制备的5 nm Mg胶体颗粒在85 °C即可完全脱氢,但纳米线与胶体颗粒在循环后易分解为纳米颗粒,结构稳定性待优化。
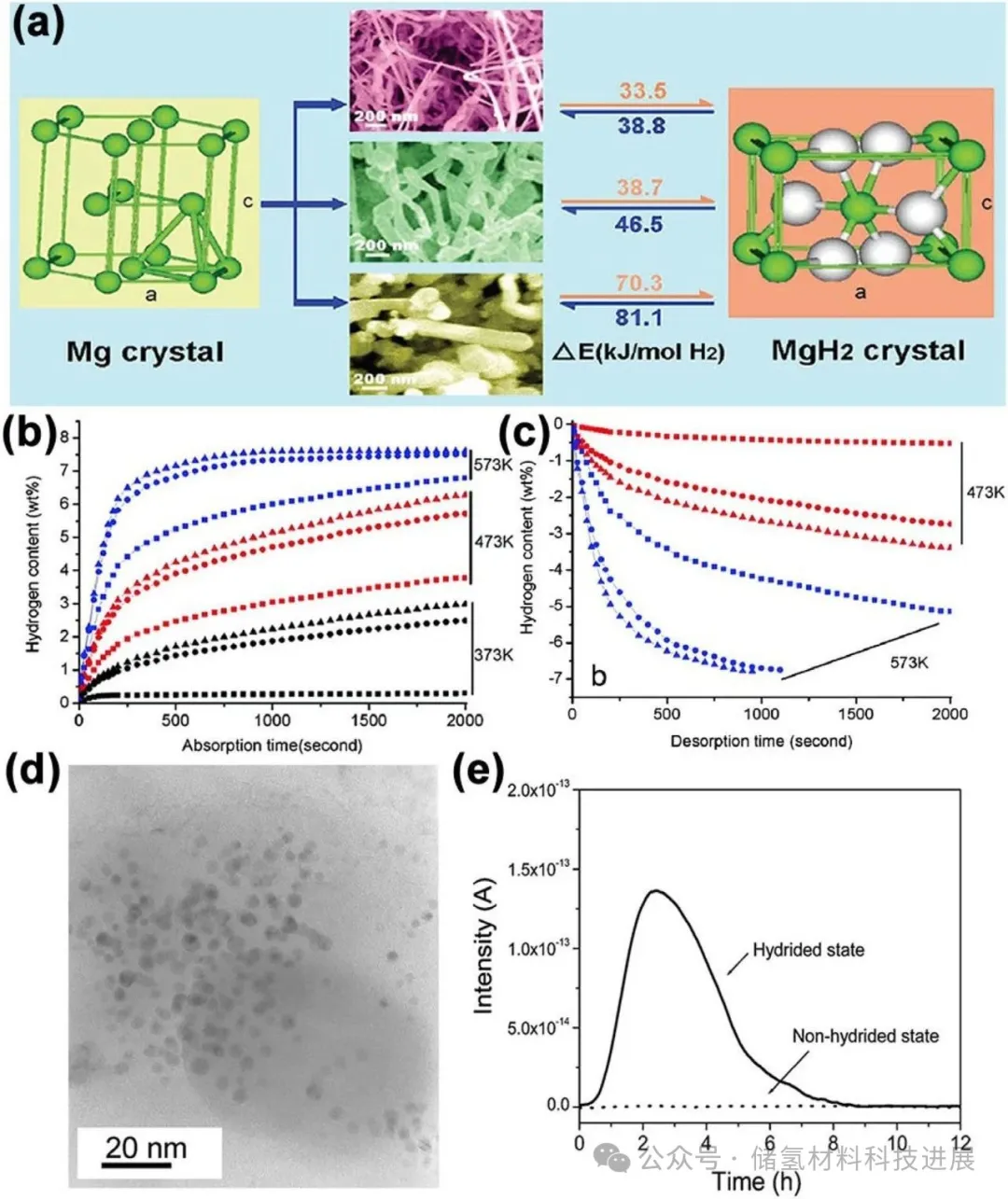
图8:(a) 气相传输法合成的三种不同直径的Mg纳米线;(b-c) Mg纳米线在373 K(黑色)、473 K(红色)和573 K(蓝色)下的吸氢与脱氢行为;(d) Mg胶体的TEM图像;(e) 85 °C下MgH₂(氢化态)和Mg胶体(非氢化态)的质谱脱氢监测
图9展示了通过MgCl₂与LiH在THF中超声辅助反应合成的4-5 nm MgH₂纳米颗粒,其40分钟内释氢6.0 wt%,200分钟后释氢6.7 wt%。理论计算表明,Mg团簇比Mg平板更具热力学与动力学优势:Mg(001)平板与团簇的氢扩散能垒、吸氢量及MgH₂释氢过程的初始态、过渡态和终态显示,纳米尺寸通过“尺寸效应”降低脱氢能垒。但纳米结构的高能量状态导致颗粒在中等温度下易团聚,需结合纳米限域技术维持稳定性。
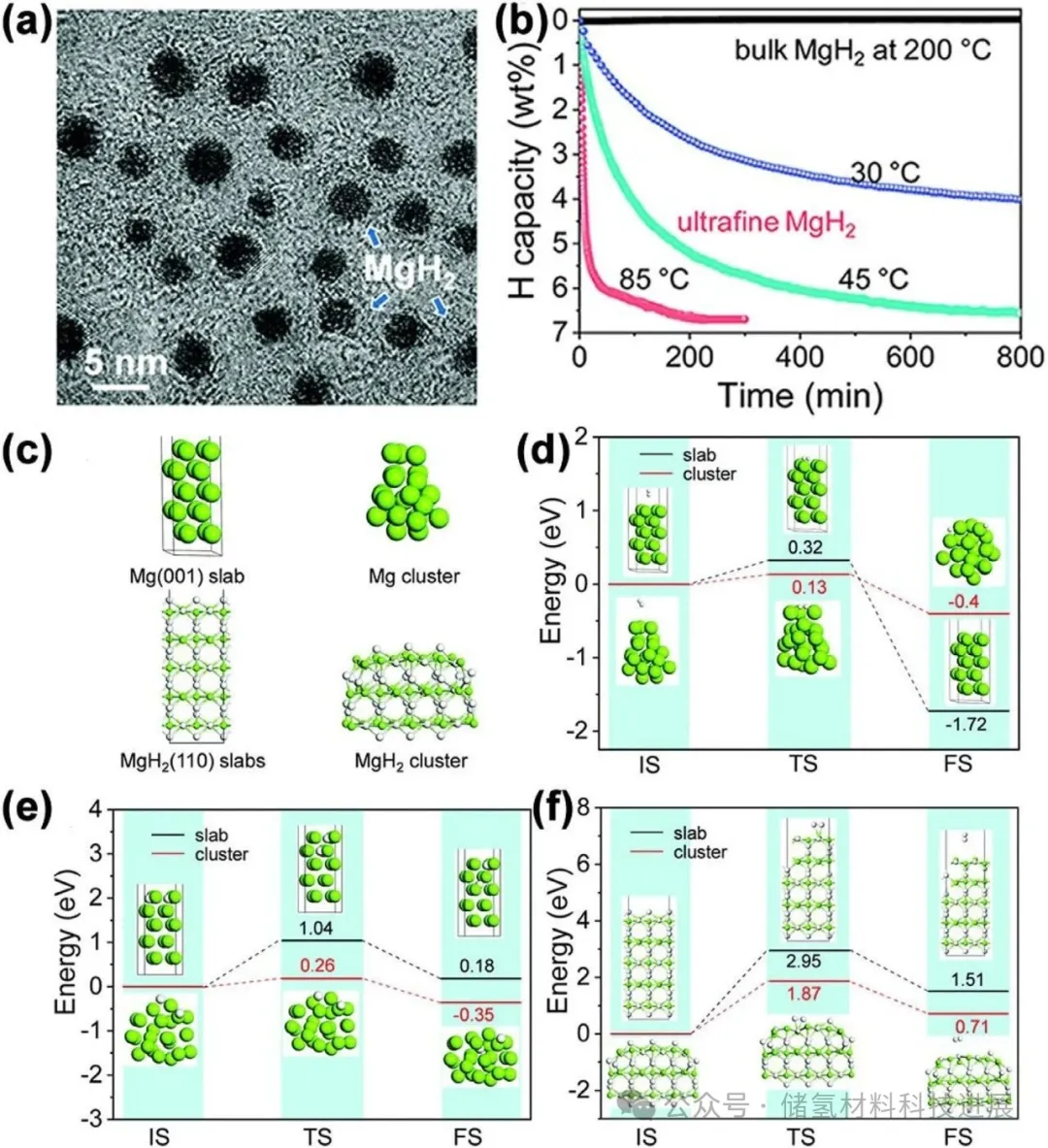
图9:(a) 超细MgH₂的TEM图像;(b) 不同温度下的等温热重脱氢曲线;(c) 块体和纳米尺寸Mg及MgH₂的计算模型;(d) Mg (001) 平板和Mg团簇的吸氢量;(e) H原子在Mg (001) 平板和Mg团簇中的扩散能垒;(f) MgH₂(110) 平板和MgH₂团簇的放氢
4. 催化作用
4.1.含碳材料
近年来,碳基材料因其轻质、结构可调、优异导热性及化学稳定性,成为催化MgH₂吸脱氢的理想添加剂,其高比表面积可为反应提供丰富活性位点,并抑制颗粒团聚与氧化。石墨、碳纳米管、碳纤维等碳基催化剂通过球磨等方法改性MgH₂时,既能通过尺寸效应细化颗粒、促进氢渗透,又能借助Mg-C相互作用降低MgH₂内聚能与氢的离子共价特性,加速脱氢动力学——例如碳改性MgH₂在300 °C下1分钟内吸氢6.6 wt%、80分钟内释氢6.3 wt%,且纳米限域技术(如PMMA包裹Mg纳米晶、CMK-3碳骨架封装MgH₂)可通过保护界面与缩短扩散路径提升循环稳定性(如Mg NCs/PMMA在200 °C下30分钟吸氢4 wt%)。此外,杂原子(B、N、P)掺杂、缺陷工程(如氧化石墨烯缺陷调控)及官能团修饰可通过改变界面电子结构、引入催化活性位点优化反应能垒——如B掺杂石墨烯催化MgH₂脱氢活化能降低,P/B共掺杂通过形成中间态H−离子加速反应;而碳材料石墨化程度对催化效果影响显著,结晶石墨可促进MgH₂吸氢,非晶碳则通过原位包覆降低脱氢起始温度(如MgH₂-CPF复合材料脱氢温度较纯MgH₂降低100 K)。
4.2.基于过渡金属的催化剂
在MgH₂性能优化研究中,过渡金属基催化剂同样展现出重要潜力。除碳基材料外,过渡金属及其合金、氯化物、氧化物和复合催化剂等衍生物,在提升MgH₂储氢能力方面具有独特优势。为清晰阐明这些不同催化剂的作用效果,相关研究已在表3中对它们的性能进行了对比总结。
4.2.1.过渡金属
过渡金属合金催化剂因不同金属元素间的协同催化机制,在MgH₂储氢性能优化中被广泛研究。Ti基合金(如TiMn2、TiVMn)、V基合金(如V80.9Ti8.4Mn10.7)等通过形成紧密连接的金属位点,显著改善MgH₂的吸脱氢动力学——例如TiMn2掺杂的MgH2在室温下氢化动力学大幅提升,VTiMn催化的MgH2吸脱氢活化能分别降至30.1和90.5 kJ/mol,且598 K下循环130次后仍保持80%储氢容量。AB型(如ZrMn2)、AB2型(如TiFe)等储氢合金则通过增加表面活性位点和界面通道,促进氢扩散,如ZrMn2催化的MgH2在300 °C下5分钟释氢6.7 wt%,100 °C下10分钟吸氢5.3 wt%。近年来,中熵合金(MEAs)和高熵合金(HEAs)因多元素协同效应成为研究热点,如CrCoNi纳米片将MgH2初始脱氢温度从325 °C降至195 °C,CrMnFeCoNi高熵合金通过“鸡尾酒效应”和表面异质性,使脱氢起始温度降至198 °C,并改变反应控制步骤从渗透控制转为扩散控制,其原位形成的金属氢化物与催化位点的“氢泵”和“溢出”效应,进一步加速了Mg/MgH2的吸脱氢过程。
4.2.2.过渡金属合金
过渡金属基催化剂在MgH₂储氢性能优化中展现显著潜力,其作用机理源于过渡金属(TM)次外层D电子与氢S电子配对以激活H₂,同时缩短MgH₂−Mg界面键距、 destabilize局部晶格,促进氢原子扩散。研究表明,Ti、Ni、Fe、V、Nb等过渡金属及其纳米颗粒均能有效提升MgH₂的吸脱氢动力学——例如Ti催化的MgH₂在10分钟内释氢超5.8 wt%,其催化效果与电负性相关(电负性越低性能越优);Ni纳米颗粒(2−6 nm)通过增强氢解离与扩散,使MgH₂在225 °C释氢6 wt%且循环9次性能稳定;Fe纳米催化剂更实现0 °C氢化与150 °C以下脱氢。此外,过渡金属氢化物(如ZrH₂、NbHx)作为掺杂剂时,可通过电子转移效应和促进Mg成核生长改善反应动力学,例如ZrH₂催化的MgH₂在65 °C、65 bar氢压下快速吸氢5.90 wt%,而纳米级催化剂因活性位点增多,其催化效果普遍优于常规催化剂。
4.3.金属化合物
过渡金属化合物(如氧化物、卤化物)与过渡金属及其合金类似,也表现出优异的催化性能。有关其催化机理的研究表明,催化活性受四个关键物理热力学性质影响:大量结构缺陷、较低但足够的稳定性(避免完全还原)、过渡金属离子的高价态以及对氢的高亲和力。这些发现表明,优化这些性质可改善镁基氢化物等储氢材料的吸放氢性能,少量合适的过渡金属化合物即可显著促进氢解吸,解决了一项重大技术挑战,而高效催化剂能促进化学吸附,推动氢原子重组为分子。
4.3.1.氧化物
过渡金属氧化物(如TiO₂、Nb₂O₅、V₂O₅、Cr₂O₃、CeO₂等)在MgH₂吸脱氢反应中展现出优异催化性能,其活性优于对应金属,少量添加即可显著提升反应动力学——例如Cr₂O₃加速吸氢、V₂O₅和Fe₃O₄促进脱氢,多价态Ti基催化剂通过电子转移降低反应能垒,稀土金属氧化物则通过形成氢化物提供催化位点。催化剂的晶面与结构对性能影响显著:暴露{001}面的锐钛矿TiO₂在200 °C下44秒吸氢5.3 wt%,3D花状TiO₂将MgH₂脱氢起始温度降至180.3 °C;直径约4 nm的ZrO₂纳米粉更将脱氢起始温度从270 °C降至163 °C,230 °C下20分钟释氢5.9 wt%,100 °C、50 bar下12秒吸氢4.0 wt%。此外,MgO作为研磨添加剂可通过细化颗粒、增加表面积改善动力学,其效果可媲美Nb₂O₅,能促进氢分子解离与氢原子扩散,降低吸脱氢活化能。
4.3.2.金属卤化物
过渡金属卤化物在提升MgH₂吸脱氢动力学方面应用广泛,性能甚至优于相应的氧化物。金属卤化物具有可还原特性,能与Mg/MgH₂反应引发结构转变,生成催化氢吸附/解吸的新活性物种,而金属氟化物的添加还能改变微观结构、抑制纳米镁颗粒团聚生长。例如,ZrCl₄与MgH₂球磨制得的复合材料,其脱氢和再氢化动力学显著改善,甚至能在0℃下实现Mg的氢化,吸脱氢活化能分别降至92 kJ/mol和40 kJ/mol(纯MgH₂为150 kJ/mol和70 kJ/mol),这归因于原位生成的ZrCl₃、金属Zr的催化作用及球磨过程中MgH₂的晶粒细化。TiF₃、NbF₅等过渡金属氟化物可与MgH₂反应形成氢化物或金属-氢固溶体,其中TiF₃因氟的高电负性加速电子转移,且能形成Mg-F键和Ti-F-Mg催化活性物种,其催化效果优于TiCl₃,同时氟离子还能抑制Mg/MgH₂晶粒生长。稀土卤化物中的F/Cl阴离子会形成MgCl₂/MgF₂新相,对MgH₂的吸放氢性能产生额外催化作用。
4.4.复合催化剂
尽管取得了一定进展,但由于单一催化剂的催化效果有限,MgH₂的动力学性能和脱附温度在某些情况下仍需进一步提升。近期研究表明,采用复合催化剂可协同改善MgH₂的动力学性能——与单一组分催化剂相比,多相催化剂能发挥额外的协同效应,在稳定与不稳定催化物种共存时展现优异活性。例如,VS₂/NiS₂多相催化剂通过原位形成Mg₂Ni/VH₂异质结构作为活性中心,将Mg/MgH₂的吸放氢活化能分别降至32.1 kJ/mol和86.7 kJ/mol;CeH₂.₇₃与Ni组成的原位复合催化剂借助“催化效应”和“氢泵效应”,使复合材料的脱氢活化能降至63±3 kJ/mol,显著低于Mg₃Ce合金和纯Mg;Ni-VOx/AC催化剂在AC、Ni和VOx的协同作用下,实现150 °C、2 MPa氢压下1分钟吸氢6.2 wt%,300 °C、1 kPa初始氢压下10分钟释氢6.5 wt%。此外,二元金属氧化物(如Li₂TiO₃、BaTiO₃)通过低价态金属离子与铁电畸变协同降低Mg-H键稳定性,碳基纳米材料(如CMK-3、CNT)与过渡金属催化剂复合则通过高比表面积和导热性改善扩散与循环性能——例如Ni/CMK-3催化的MgH₂吸脱氢活化能分别降至37.4 kJ/mol和43.4 kJ/mol,CNT的引入可缓解颗粒体积变化、提升循环稳定性。这些复合催化剂通过“电子转移效应”、“氢泵效应”、“扩散通道构建”等机制,协同实现了MgH₂储氢性能的优化。
4.5.结论与展望
综上所述,镁基储氢材料因其高储氢容量、安全性和丰富的可获得性,在可持续能源应用中展现出巨大潜力。然而,动力学缓慢和操作温度高等挑战阻碍了其实际应用。本综述重点介绍了两种主要改性策略的进展:纳米结构化和催化。
此外,尽管对催化MgH₂的研究广泛,但缺乏有效的理论指导限制了高效储氢材料的合理设计。建立全面的数据库以指导和优化MgH₂基体系的开发至关重要。而且,尽管在改性MgH₂方面已取得进展,但仍需要进一步创新来解决导热性和实际应用规模化等长期存在的问题。先进纳米结构化、催化增强和理论建模的协同结合,有望克服这些挑战并实现MgH₂在储氢技术中的全部潜力。现将观点与挑战总结如下:
(1)尽管关于MgH₂催化的报道众多,但仍严重缺乏有效的理论指导。建立全面的数据库以提供合理的设计策略和指南,用于开发针对各种应用的高效MgH₂储氢材料至关重要。通过构建这一知识储备库,研究人员可以系统地设计和优化MgH₂基材料,确保在不同场景下具有更好的性能和适用性。解决这一差距对推进MgH₂在储氢技术中的实际应用至关重要。
(2)尽管MgH₂纳米结构化已取得显著进展,显著提高了其脱氢温度和动力学性能,但超细MgH₂纳米颗粒的大规模生产仍是一项重大挑战。虽然机械球磨可以实现大规模生产,但通过该方法对MgH₂的粒径控制不足以满足实际应用需求。因此,进一步研究应侧重于开发简单高效的超细MgH₂纳米颗粒制备方法。
(3)尽管在改性MgH₂方面已取得相当大的进展,但将其作为固态储氢材料实际应用时仍存在若干问题。当与燃料电池结合使用时,MgH₂在85°C以下的温度下,在脱氢容量、脱氢速率和脱氢压力方面仍面临重大挑战。这需要创新的科学和工程解决方案,以有效弥合MgH₂储氢材料与质子交换膜燃料电池(PEMFC)之间的差距。
(4)MgH₂储氢系统的导热性是实验室测试条件下常被忽视的另一个关键参数。在MgH₂应用规模化时,给定温度下Mg粉内外层的温度梯度差异会导致脱氢容量和速率的显著变化。解决这些差异对MgH₂的成功大规模应用至关重要.
文章来源于微信公众号:储氢材料科技进展
9月9日从锡山区发展改革委获悉,锡山区近年来锚定氢能产业这一未来赛道,依托装备制造底蕴,精准布局产业链关键环节,其中不乏魔方氢能、华镁时代、盛鑫氢能等一批在细分领域“身怀绝技”的企业。

盛夏的太湖之畔,江苏华镁时代科技有限公司研发中心里,一位身形壮硕、语速温和却眼神坚定的工程师正对着三维模型反复推敲。他叫陶德伟,入职仅数月,却已把名字写进了公司“镁好”史册:由他牵头的某央企镁基固态储氢系统项目,以零设计变更、零现场返工、提前完成交付的成绩。今天,让我们循着镁光的轨迹,走近这位“把氢能经验嫁接到镁时代”的系统工程师,聆听一段关于梦想、专业与成长的故事。

